La Esterilización está destinado a generar Dispositivos médicos reutilizables (DMR) libres de microorganismos viables
![]() Los Priones no son microorganismos y son más resistentes que los microorganismos convencionales.
Los Priones no son microorganismos y son más resistentes que los microorganismos convencionales.
La esterilización de DMR se basa en 3 conceptos claves
- Nivel de aseguramiento de la esterilidad (SAL): No es posible controlar sistemáticamente la ausencia total de microorganismos viables. El objetivo de la esterilización es limitar la probabilidad de sobrevivencia de los microorganismos a un nivel muy bajo. Para los DMR, la probabilidad o nivel de aseguramiento de la esterilidad (SAL) se expresa como: no mayor que 1 microorganismo viable en una cantidad de un millón de artículos esterilizados (o SAL 10-6 ).
- Sobreletalidad: Se desconoce la cantidad, naturaleza y ubicación de los microorganismos que pueden estar presentes en un DMR después de la limpieza. Los procesos de esterilización de los DMR deben demostrar su capacidad para inactivar un inóculo altamente concentrado, mayor a 1 millón de microorganismos de prueba. Los microorganismos de prueba se seleccionan con una alta resistencia al proceso de esterilización. Este margen conservador, por encima del nivel más alto de contaminación de la vida real, se denomina método de sobreletalidad.
- Compatibilidad:los DMR siguen siendo completamente funcional y seguros para su uso después de la esterilización. La compatibilidad es verificada por el fabricante del DMR, que determina el número máximo de ciclos de esterilización a los que se puede exponer un DMR, antes de ser desechado o reparado.
Varios métodos han sido propuestos por normas internacionales para demostrar la capacidad de un proceso de esterilización dado, para alcanzar el SAL mediante el método de sobreletalidad. Uno de ellos es el método de Sobreletalidad de medio ciclo, que se describe a continuación:
| Las pruebas se realizan con microorganismos conocidos por su alta resistencia al proceso de esterilización (generalmente esporas bacterianas). Se prepara un inóculo de 106 (6 log) y se coloca en la cámara de esterilización. Los inóculos se exponen a tiempos crecientes (o dosis crecientes). Las pruebas se repiten y los resultados se promedian. La cinética de inactivación se caracteriza por el valor D, es decir, el tiempo necesario para reducir la población microbiana en un 90% ó 1 log. Si la cinética de inactivación es lineal, al duplicar el tiempo o la dosis que mata 106 microorganismos, obteniendo el SAL 10-6. Por ejemplo, un proceso con un valor D de 2 minutos, inactiva 6 log en 12 minutos y alcanza el SAL en 24 minutos. Una vez que se ha caracterizado el proceso, se debe verificar que un DMR puede ser esterilizado de manera eficiente. El inóculo 106 se coloca en la posición determinada como la más difícil de esterilizar en o dentro de un DMR. Los DMR se empaquetan e insertan en una carga desafiante representativa. Las instrucciones de uso del fabricante del DMR indican el número máximo de usos antes de su eliminación o reparación. Para los controles de rutina, los inóculos se pueden colocar en dispositivos de desafío de proceso (DDP) |
Los proceso de esterilización por los cuales el DMR se esteriliza dentro de un embalaje que conserva su esterilidad hasta que se utiliza se denomina esterilización terminal.
La esterilización terminal se puede obtener tanto a alta temperatura como a baja temperatura.
Steam sterilization La Esterilización por vapor es el método de esterilización más común. También se conoce como esterilización por calor húmedo o esterilización por vapor saturado, La tecnología de esterilización se caracteriza por un agente esterilizante, las variables de proceso y los parámetros de proceso. Por ejemplo, en el caso de la esterilización con vapor, el agente esterilizante es vapor saturado. Las variables del proceso son la presión, la temperatura, y el tiempo. 134 ° C es un ejemplo de un parámetro de proceso de temperatura. El agente esterilizante se obtiene mediante la vaporización de un esterilizante líquido (por ejemplo, El H2O2 líquido es el esterilizante para el H2O2 vaporizado), o por la producción in situ (por ejemplo, ozono). |
![]() La esterilización por radiación (ionizante – gamma, rayos electrónicos o rayos X de alta energía, o ultravioleta no ionizante (UV)) no se usan comúnmente para el reprocesamiento de DMR en centros de salud y no se tratarán en las presentes directrices.
La esterilización por radiación (ionizante – gamma, rayos electrónicos o rayos X de alta energía, o ultravioleta no ionizante (UV)) no se usan comúnmente para el reprocesamiento de DMR en centros de salud y no se tratarán en las presentes directrices.
Los métodos de esterilización no terminal cumplen con los criterios SAL. Sin embargo, a diferencia de la esterilización terminal, los DMR no se protegen por empaques. La esterilización por vapor de uso inmediato (anteriormente denominada esterilización flash) es un ejemplo de proceso de esterilización no terminal.
Todos los procesos de esterilización requieren precauciones de salud y seguridad ocupacional
- La alta presión en las cámaras de esterilización con vapor, implica el control periódico de la integridad de la cámara, de acuerdo con las regulaciones o recomendaciones.
- En la esterilización con vapor a alta temperatura y la esterilización por calor seco se corre el riesgo de sufrir quemaduras. Los DMR tienen tiempo de enfriamiento y los operadores deben usar guantes.
- Todos los productos químicos usados para baja temperatura son tóxicos a diferentes niveles (por eso su eficacia en los microorganismos). Los controles periódicos verifican la ausencia de fugas. Antes de acceder a un DMR, los residuos se eliminan a los niveles definidos por las regulaciones de seguridad y salud ocupacional aplicables.
En el mercado se ofrecen varios tamaños y configuraciones de esterilizadores.
- Los esterilizadores grandes se utilizan en las instalaciones de una central de esterilización. A menudo son sistemas de doble puerta (con entrada y salida).
- Los esterilizadores de sobremesa y de una puerta se utilizan en clínicas ambulatorias, dentales y rurales.
La elección del método de esterilización se realiza de acuerdo con los pricipios de Clasificación de Spaulding y las regulaciones o recomendaciones locales aplicables.
Las preferencias o tendencias comunes se pueden resumir de la siguiente manera:
- La esterilización terminal se prefiere a la esterilización no terminal para los DMR que entran en cavidades estériles.
- La esterilización por vapor se recomienda para DMR compatibles con humedad y calor. Los ciclos de vapor más eficientes son los de 132 ° C (270 ° F) o 134 ° C. El tiempo de meseta requerido o recomendado varía desde 3 minutos hasta 18 minutos según la normativa aplicable.
- La esterilización por calor seco está prohibida en un número creciente de países debido a su propiedades fijadoras y malos resultados en comparación con la esterilización por vapor.
- Para los DMR sensibles al calor, la elección del método de esterilización terminal a baja temperatura (LTS) sigue las instrucciones de uso de los fabricantes del DMR y puede estar influenciado por convenciones, pautas o regulaciones regionales. El peróxido de hidrógeno vaporizado (VH2O2) es el método LTS más aceptado. El formaldehído de vapor a baja temperatura (LTSF) no se utiliza en países con fuertes regulación de priones, debido a sus propiedades fijadoras. El uso de EtO depende del país debido a las propiedades fijadoras, el largo tiempo de aireación y las restricciones de seguridad y salud ocupacional.
- En algunos países no se utiliza la IUSS no terminal. Sigue siendo tolerado en otros, pero generalmente con recomendaciones para usar esterilización terminal con vapor.
- La aceptación de procesos esterilizantes líquidos no terminales es dependiente de la región. En un proceso con líquido esterilizante, el DMR se sumergen en una solución consiguiendo 10-6 SAL. Luego se enjuagan los DMR. Los DMR no están protegidos por un embalaje. Por tanto, los procesos de esterilización líquida no son terminales.
El nivel de flexibilidad que se deja al usuario para elegir el método de esterilización, depende de las normas o regulaciones locales. Por ejemplo, en algunos países se utiliza vapor, excepto cuando no está permitido por la instrucciones de uso del fabricante del DMR. En otros países, esterilización a baja temperatura se usa o se tolera para dispositivos compatibles con vapor que se sabe que se deterioran por la exposición repetida al vapor (por ejemplo, ópticas).
La conformidad de un proceso de esterilización a normas internacionales puede ser requerido por las regulaciones locales aplicables.
![]() Las Normas específicas están disponibles para vapor1,2,3,4,5 para calor seco6, para EtO7,8 y LTSF9,10. La ISO 14937 se utiliza para VH2O2 (actualmente se están desarrollando normas específicas) 12,13. No existen normas internacionales directamente aplicables para los procesos de esterilización con líquidos y IUSS.
Las Normas específicas están disponibles para vapor1,2,3,4,5 para calor seco6, para EtO7,8 y LTSF9,10. La ISO 14937 se utiliza para VH2O2 (actualmente se están desarrollando normas específicas) 12,13. No existen normas internacionales directamente aplicables para los procesos de esterilización con líquidos y IUSS.
Los ciclos de esterilización se puede dividir en 3 fases.
- El Acondicionamiento prepara la cámara de esterilización y un DMR empaquetado para una esterilización eficiente. Por ejemplo, la temperatura de la cámara se lleva a un nivel predeterminado y el aire que actúa como amortiguador entre el agente esterilizante y las superficie del DMR se elimina creando vacío. Los perfiles de acondicionamiento varían (por ejemplo, un vacío o varias fases de vacío). Con algunas tecnologías de esterilización (por ejemplo, EtO), la fase de acondicionamiento del ciclo de esterilización puede estar precedida por un preacondicionamiento (por ejemplo, para llevar un DMR dentro de un rango predefinido de temperatura y humedad).
- La Exposición al agente esterilizante por un tiempo predefinido y en condiciones controladas logrando el SAL. La exposición incluye el tiempo necesario para distribuir el agente esterilizante en la cámara, a través del embalaje y en todas las superficies de un DMR, incluidos los lúmenes.
- La Remoción de los residuos de esterilización permite abrir la puerta de la cámara de forma segura. Podría ser necesaria una fase de aireación prolongada para la desorción de sustancias químicas tóxicas del material absorbente (por ejemplo, en el caso del EtO). Cualquiera que sea la tecnología de esterilización, las medidas adecuadas de salud y seguridad ocupacional se definen y aplican estrictamente. El aire filtrado es ingresado en la cámara para eliminar la condensación (del vapor) o para purgar los residuos tóxicos de la cámara y las superficies de carga. La eliminación de residuos puede ser asistida por presión, variación de T ° C u otros medios. Con la esterilización a alta temperatura, los DMR se dejan enfriar. Si es necesario, la aireación durante o después de que el ciclo permite la desorción de residuos tóxicos de la carga.
Los procedimientos operativos estándar (POE) escritos describen la operación y los controles que se realizarán antes, durante y después del ciclo de esterilización. Para un DMR recién adquirido, se define un nuevo POE si no hay uno existente que pueda ser utilizado.
- La fecha de vencimiento de consumibles (esterilizante y otros) se comprueba sistemáticamente. El producto que supera la fecha de vencimiento se desecha de acuerdo con las instrucciones de uso del fabricante y las regulaciones locales.
- La composición de la carga está predefinida.
Cada articulo lleva un indicador químico (CI). Norma internacional ISO 11140-114 clasifica los indicadores químicos en 6 tipos (sin importancia jerárquica) como se indica en la tabla 1. La mayoría de las guías locales solicitan un IC de tipo 1. Algunas pautas sugieren indicadores adicionales de tipo 3, 4, 5 o 6. Tabla 1.
Tabla 1. Clasificaciones de indicadores químicos
| Tipo | Nombre | Descripción |
| 1 | Indicador de Proceso | Se preparan para el uso con unidades individuales (packs o contenedores) para distinguir entre unidades procesadas y no procesadas. El indicador tipo 1 son usualmente incluídas en el embalaje o accesorios de embalaje. |
| 2 | Indicadores para el uso en test específica | Se preparan para usarse en un procedimiento específico de un test, tales como, el test de Bowie-Dick para la remoción de aire en los ciclos de vacío previos. Varios tipos de Indicadores de Bowie Dic son descritas por las normas internacionales ISO 11140-3 a ISO 11140-6 14,15,16,17 |
| 3 | Indicadores de variable única | Reacciona a una de las variables de esterilización, por ejemplo tiempo y temperatua, y son preparados para indicar la exposición a una predeterminada variable del proceso de esterilización, por ejemplo 134°C. |
| 4 | Indicadores multivariables | Reacciona a dos o más variables de esterilización, por ejemplo tiempo y temperatura , y son preparados para indicar exposición a predetermindas variables de proceso de esterilización, por ejemplo 134°C, 3 minutos. |
| 5 | Indicadores integradores | Reacciona a todas las variables críticas del proceso de esterilización, por ejemplo: tiempo y temperatura, y son preparados para ser equivalentes o exceden los requerimientos de desempeño dados en la serie ISO 11138 (ver más abajo) para indicadores biológicos. |
| 6 | Indicadores emuladores | Reacciona a todas las variables críticas del proceso de esterilización, por ejemplo: tiempo, temperatura y presencia e humedad, y son preparados para coincidir con las variables de un ciclo especifico de esterilización. |
- El uso de indicadores biológicos (BI) depende de las reglamentaciones o directrices de un país y de la tecnología de esterilización. BI’s cumple con estándares internacionales19,20,21,22,23,24 Los indicadores biológicos son frecuentemente indicadores biológicos autocontenidos (SCBI)
| En un SCBI, se encuentra la espora y el medio necesario para la incubación y recuperación de los microorganismos de prueba están contenidos en un sistema de barrera estéril. Después de la exposición, el medio se pone asépticamente en contacto con la espora. La respuesta proporcionada por el SCBI es binaria: crecimiento/ no crecimiento. El tiempo de lectura varía desde 48 horas hasta unas pocas horas e incluso menos con la nueva generación de indicadores biológicos. El indicador biológica de lectura rápida detecta enzimas que simulan de forma confiable el comportamiento de los microorganismos de prueba. El SCBI a menudo incluye una función de dispositivo que desafía el proceso. Un dispositivo de desafío de proceso se define en la norma internacional ISO 11139 (2018) como "un item que proporciona una resistencia conocida para un proceso de limpieza, desinfección o esterilización y se utiliza para evaluar el desempeño del proceso". En el caso de un SCBI, un camino tortuoso desafía la penetración del agente esterilizante en la cápsula que contiene el indicador biológico. Para que sea significativo, el desafío de los PCD debe compararse con los dispositivos médicos reutilizables destinados a la esterilización. Los indicadores biológicos se colocan en una posición desafiante en la carga. |
- La disposición de la carga permite una distribución uniforme del agente esterilizante. La carga tiene en cuenta consideraciones de salud ocupacional y seguridad laboral
- Los Controles de rutina (si es necesario) se realizan con la periodicidad recomendada por la norma internacional o la definida por las regulaciones locales.
- Los Ciclos se adaptan a la carga. El Control del ciclo está automatizado, pero el personal debe estar presente y capacitado para reaccionar ante situaciones de alarma y peligro. Las Normas internacionales requieren medios para detectar la desviación del sistema de control y el registro independiente de los datos del ciclo.
| Un fabricante de esterilizadores debe proporcionar los medios para evitar una falla del software o del hardware del sistema de control, que sigue sin detectarse, y que un ciclo no válido parece válido. En la práctica, los sensores independientes verifican dos veces que las variables del proceso estén dentro de las tolerancias especificadas. Por ejemplo, en el caso de la esterilización con vapor, el sensor de temperatura que regula la temperatura del proceso se duplica mediante un sensor de temperatura independiente. La tecnología de sensor independiente no tiene por qué ser la misma siempre que se detecte de forma fiable la desviación de la función de control. Las instrucciones de uso del fabricante proporcionan instrucciones al usuario en caso de que se detecten desviaciones. Los datos independientes deben registrarse para su trazabilidad. |
- Los controles posteriores al ciclo se describen con precisión, los resultados se registran y las desviaciones se registran y se informan como se define en un POE. Cada artículo se controla visualmente. Si no se realiza antes de la esterilización, se implementa el etiquetado para la trazabilidad. Se controlan los parámetros del ciclo. Se controlan los cambios de color de los indicadores químicos de tipo 1. Otros indicadores de control (si se utilizan) se controlan y los indicadores biológicos (ver más abajo) se envían para incubación.
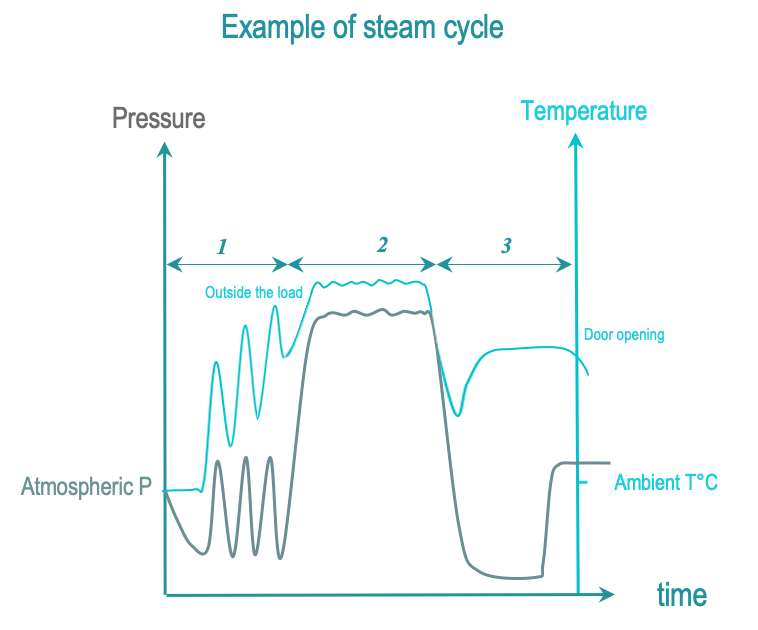
En la esterilización con vapor, el vapor saturado caliente cubre todas las superficies del DMR durante un tiempo específico establecido de acuerdo a las guías. Saturado significa que el vapor se mantiene en un estado entre una fase líquida y una fase de vapor estable, con un porcentaje muy bajo de la fase líquida. La tabla de Regnault proporciona las condiciones de presión y temperatura para la saturación del vapor.
Las temperaturas superiores a 100°C, se obtienen aumentando la presión en la cámara de esterilización por encima de la presión atmosférica.
Un test de penetración de vapor y un test de fuga o estanqueidad se deben realizar periódicamente según las recomendaciones de las normas internacionales o las impuestas por las normativas locales (normalmente a diario)
Las 3 fases de los ciclos de esterilización por vapor son las siguientes:
- Acondicionamiento: sucesivos vacíos e injecciones de vapor, extraen aire de la cámara y la carga. la que es reemplazada con vapor saturado. La temperatura de la carga aumenta progresivamente.
- Exposición: Se completa la inyección de vapor saturado y se le da tiempo para que se difunda a través de la carga. Todas las superficies de un DMR deben estar expuestas al vapor saturado. La temperatura y el tiempo de exposición están definidos por las normas o regulaciones locales. Las temperaturas comúnmente utilizadas son 134°C o 132°C (270°F), dependiendo de la región. Los tiempos de meseta (esterilización) varían de 3 a 18 minutos (debido a la regulación de priones). Durante la fase de exposición, la condensación y las disminuciones de temperatura se compensan mediante inyecciones de vapor saturado hasta el final del período de meseta. Cuando se especifica en las instrucciones de uso de un fabricante de DMR, la temperatura se reduce a 121°C o 125°C con tiempos de exposición de 15 minutos o más.
- Eliminación (secado): La condensación se elimina mediante vacío y calentamiento. Abra la puerta para permitir que la carga se enfríe y el operador pueda manejar la carga de forma segura.
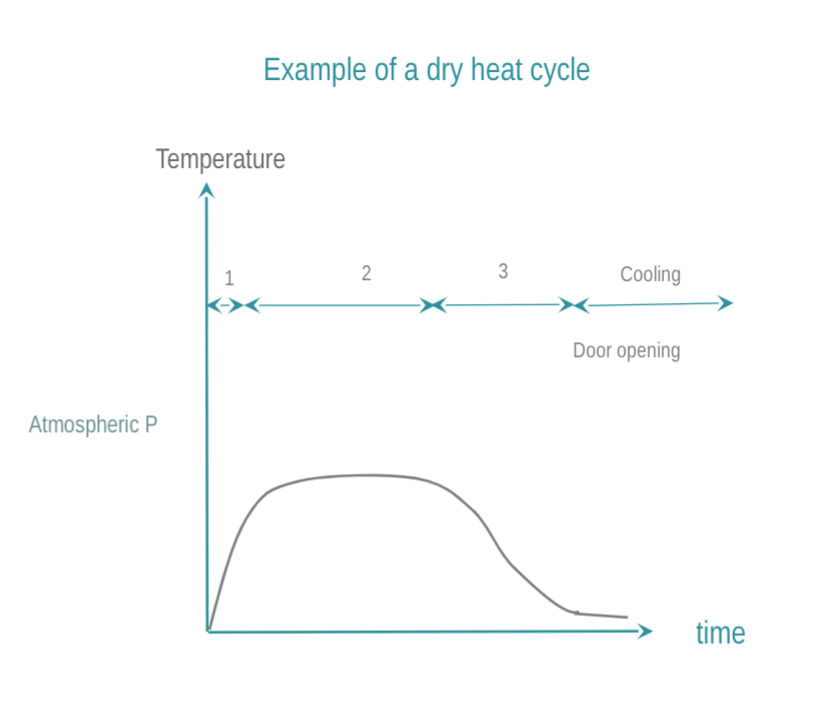
El calor seco consigue la esterilización mediante conducción del calor. El DMR absorbe el calor y este se mueve dentro de un DMR capa por capa. Para que el DMR esté completamente esterilizado, debe alcanzar la temperatura requerida. En comparación con la esterilización con vapor, la T ° C del calor seco y el tiempo requerido para la eficacia son más altos y más largos, los rendimientos de penetración son deficientes y los tiempos de enfriamiento son más largos. El calor seco está prohibido en un número creciente de países debido a sus propiedades fijadoras. Cómo realizar la esterilización en seco:
- La cámara se lleva a la temperatura deseada. El calor seco se fuerza preferiblemente a través de la cámara de esterilización (esterilizadores que tienen incorporado ventiladores).
- Un DMR se mantiene a la temperatura objetivo durante un tiempo predeterminado. La temperatura y el tiempo habituales son 160 ° C (320 ° F) durante 2 horas, 170 ° C (340 ° F) durante 1 hora, o 190 ° C en el caso de los esterilizadores de aire caliente de alta velocidad.
- debe estar establecido el tiemp de enfriamiento de la cámara y de la carga para la seguridad del operador. El enfriamiento puede prolongarse después de abrir la puerta del esterilizador.
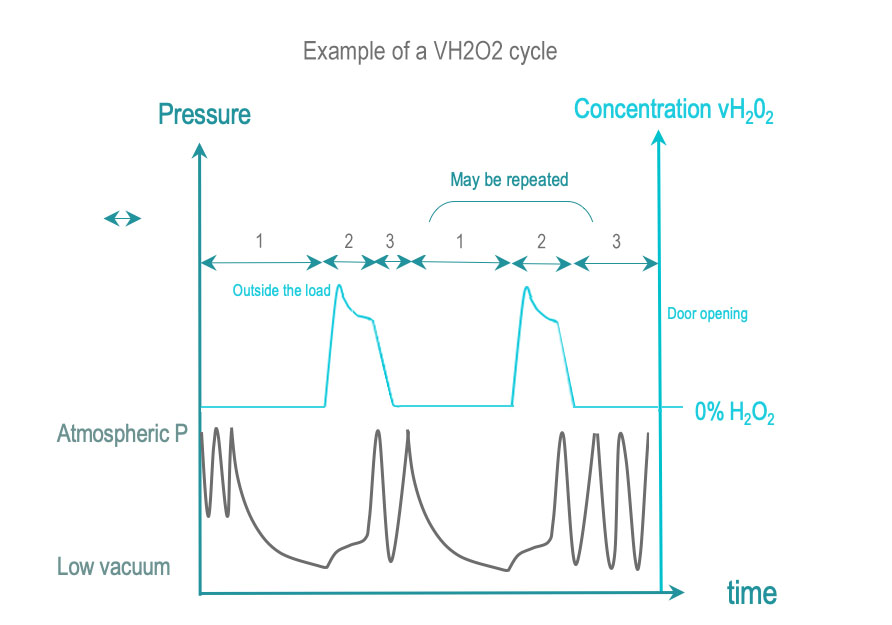
La esterilización con peróxido de hidrógeno vaporizado pone en contacto las superficies DMR con H2O2 vaporizado (VH2O2) a una determinada concentración y tiempo de proceso para lograr el SAL requerido. El VH2O2 se obtiene mediante la vaporización de una solución esterilizante líquida (normalmente la concentración es superior al 50%). Algunos ciclos aumentan la concentración de VH2O2 antes de su distribución dentro de la cámara de esterilización.
- Acondicionamiento: El aire se extrae mediante vacíos únicos o repetidos que también pueden contribuir, junto con otros métodos, a la eliminación de las trazas de humedad residual. La carga se hace llegar a un rango de temperatura predeterminado.
- Exposición: el H2O2 vaporizado se inyecta y difunde en la cámara, a través de la carga y el embalaje, y en geometrias complejas (lumenes y otros). El H2O2 se descompone cuando interactúa o es absorbido por el material. Una dosis de H2O2 se entrega a la cámara y asegura que todas las superficies estén expuestas al tiempo y las condiciones de concentración requeridas para SAL. La concentración de H2O2 se controla directa o indirectamente mediante la presión.
- Eliminación: El agua y el H2O2 residuales dejados o adsorbidos por la carga se eliminan mediante vacío o medios adicionales
Los esquemas de acondicionamiento, exposición y eliminación pueden repetirse una o varias veces. El acondicionamiento y la repetición de las fases son más simples en comparación con el acondicionamiento inicial. Por lo general, el número total de fases repetidas (incluida la primera) es par. El ciclo termina con una remoción final generalmente reforzada en comparación con las remociones previas.
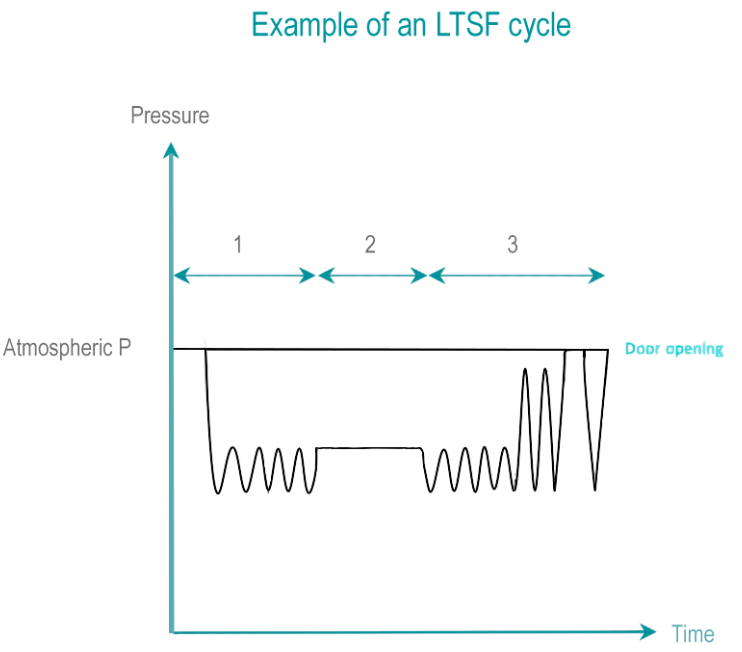
El formaldehído (HCHO) es un gas incoloro, altamente soluble en agua. El formaldehído se obtiene mediante la vaporización de una solución a diversas concentraciones de formaldehído (por debajo del 35%). El poder de inactivación del formaldehído se mejora en gran medida por la presencia de humedad.
- Acondicionamiento: un vacío inicial elimina el aire de la cámara y la carga. El aire residual se reemplaza progresivamente por vapor y formaldehído mediante pulsos de presión.
- Tiempo de exposición: durante el tiempo de exposición, la temperatura, la concentración de esterilizante, la presión y la humedad se mantienen dentro de rangos predeterminados. El LTSF opera a 80, 65, 60, 55 o 50 ° C (176, 149, 140, 131 o 122 ° F) con una humedad relativa de 75 a 100%.
- Eliminación: la mezcla de formaldehído y vapor se elimina de la carga mediante lavados repetidos de vacío y vapor, seguidos de un vacío profundo. La aireación permite la desorción de formaldehído de un DMR a niveles que no serán dañinos para los operadores y los pacientes. Los residuos de formaldehído líquido se diluyen al nivel permitido por las normas locales de gestión de residuos.
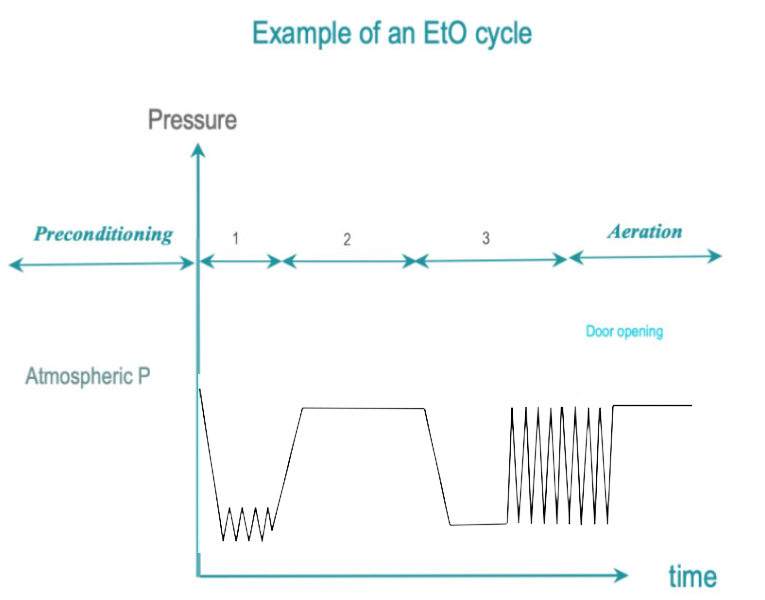
El EtO es un gas venenoso e incoloro que ataca las proteínas celulares y los ácidos nucleicos de los microorganismos. Las temperaturas del proceso de EtO oscilan entre 25 y 55 ° C. Una temperatura más baja da como resultado un proceso menos eficiente y un tiempo de exposición más prolongado. EtO es cancerígeno para los seres humanos e inflamable. Se requieren condiciones especiales de la habitación, equipo de seguridad y sistemas de ventilación separados.
- Acondicionamiento: El aire residual se elimina mediante pulsos de vacío y se reemplaza progresivamente por EtO mezclado con vapor. La temperatura y la humedad de la carga se ajustan a niveles predeterminados. Es posible que se requiera acondicionamiento previo para llevar grandes cargas dentro de rangos predeterminados de humedad y temperatura.
- Exposición: la concentración, la humedad y la temperatura de EtO buscadas se estabilizan hasta el final del tiempo de exposición predeterminado.
- Eliminación: los residuos de EtO se eliminan mediante pulsos de vacío. Durante una fase de aireación, se da tiempo al EtO para que se desorba de la carga. La aireación puede continuarse fuera de la cámara bajo condiciones de seguridad y salud ocupacional estrictamente controladas El tiempo total de aireación varía entre 12 y 48 horas.
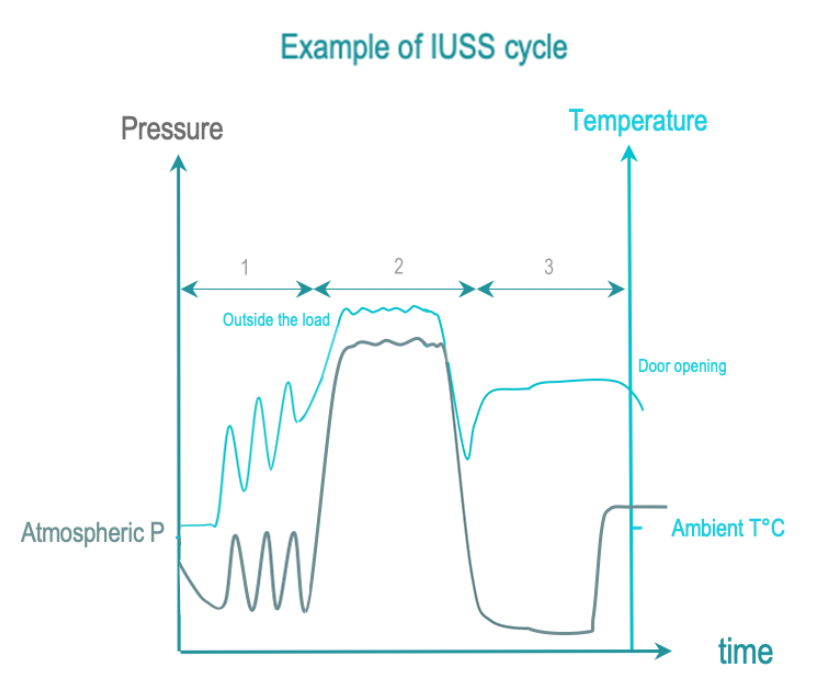
La esterilización por vapor de uso inmediato (IUSS) es una variante de la esterilización por vapor destinada a la esterilización no terminal en el punto de uso y de emergencia. Los DMR no están empaquetados. La transferencia al usuario es inmediata y se realiza con cuidado en un ambiente controlado. En comparación con la esterilización con vapor, los DMR no están empaquetados, el secado y el enfriamiento generalmente se acortan para limitar el tiempo del ciclo. Por lo tanto, es posible que un DMR aún esté húmedo al finalizar el ciclo, lo que aumenta el riesgo de contaminación ambiental.
Las 3 fases de IUSS son las siguientes:
- Acondicionamiento: La inyección de vacío y vapor extraen el aire de la cámara y la carga, y lo reemplaza con vapor saturado. La temperatura de la carga aumenta progresivamente.
- Exposición: La inyección de vapor saturado se completa y se le da tiempo para que se difunda por toda la carga.
- Eliminación: La condensación se elimina mediante vacío y calentamiento. Se permite que la carga se enfríe después de abrir la puerta para que el operador la manipule con seguridad.
Algunos países no permiten IUSS, otros pueden tolerarlo. Las recomendaciones suelen aconsejar la realización de una evaluación con respecto a la necesidad de reprocesamiento en el lugar de uso. Puede ser necesario mejorar el inventario de los DMR para permitir el reprocesamiento por parte de un departamento central de esterilización.
![]() No existen normas internacionales para IUSS.
No existen normas internacionales para IUSS.
![]() Las regulaciones o normas locales pueden requerir o recomendar que la esterilización se lleve a cabo en un departamento de esterilización centralizado, prohibiendo así la esterilización en el lugar de uso. Los quirófanos no suelen estar equipados ni organizados para limpiar y secar DMR de forma como lo hace el departamento de esterilización centralizado.
Las regulaciones o normas locales pueden requerir o recomendar que la esterilización se lleve a cabo en un departamento de esterilización centralizado, prohibiendo así la esterilización en el lugar de uso. Los quirófanos no suelen estar equipados ni organizados para limpiar y secar DMR de forma como lo hace el departamento de esterilización centralizado.
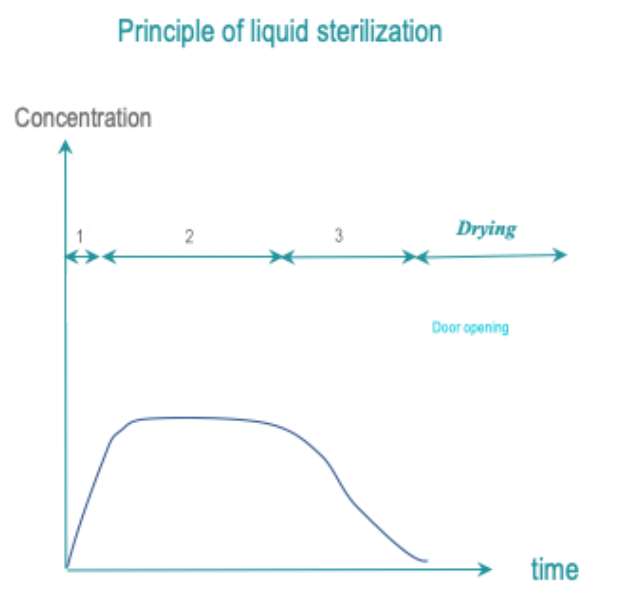
La exposición de todas las superficies de DMR a un esterilizante líquido durante un tiempo, temperatura y concentración controlados produce un SAL específico. El enjuague debe conservar este SAL.
El esterilizante más común es el ácido peracético. La limpieza suele estar separada de la aplicación del esterilizante.
La aceptación del concepto de esterilizante líquido depende de la región. En algunos países, puede aceptarse o tolerarse como una alternativa a la esterilización a alta o baja temperatura para algunos DMR frágiles o sensibles al calor. En otros países, esta práctica puede considerarse como una desviación delos principios de la Clasificación de Spaulding.
- Acondicionamiento: Es posible que no se requiera acondicionamiento. La limpieza puede estar incluida en el ciclo o realizarse por separado.
- Exposición: Todas las superficies del DMR se exponen al esterilizante a una temperatura y a condiciones predeterminadas y durante un tiempo predeterminado.
- Eliminación: Los residuos de esterilizante se eliminan mediante enjuague. El enjuague conserva la SAL. Si el secado está incluido en el ciclo, el secado debe conserva la SAL.
Los procedimientos operativos estándar (POE) escritos de limpieza y desinfección están preparados de acuerdo con los principios de gestión de la calidad.
El usuario supervisa o lleva cabo, y controla la validación del proceso :
- La instalación del Esterilizador cumple con las recomendaciones del fabricante
- Las instrucciones de uso del fabricante, los certificados de prueba y calibración están disponibles
- Los Procedimientos operativos estándar (POE) están actualizados. Para los DMR recién comprados, se define un nuevo POE si no se debe usar uno existente.
- Los Controles de rutina son adecuados
- Las medidas de Salud y seguridad ocupacional son adecuadas
- Los planes de Formación (incluida la formación en medidas de seguridad y salud ocupacional) están actualizados y ejecutados, y los certificados de formación están disponibles.
- Los planes de Mantenimiento son adecuados para todos los equipos de esterilización.
- La Trazabilidad está operativa.

Recomendaciones clave de WFHSS para limpieza y desinfección
- La Esterilización terminal, conforme a normas internacionales, se prefiere a la esterilización no terminal.
Para métodos de esterilización terminal, el vapor a 134 ° C o 132 ° C son las temperaturas de esterilización preferidas y se pueden utilizar cuando lo especifiquen las instrucciones de uso del fabricante del DMR. El tiempo de exposición varía según las normativas o directrices del país.
La esterilización por Calor seco debería sustituirse por vapor.
Para los DMR que no son compatibles con vapor a 132 ° C o 134 ° C, las instrucciones de uso del fabricante indican los métodos de esterilización y los ciclos que se utilizarán, ya sea vapor entre 121 ° C y 125 ° C o esterilización a baja temperatura. La elección de los métodos LTS se realiza de acuerdo con las normativas, directrices, consideraciones prácticas, o de salud y seguridad ocupacional.
Las afirmaciones sobre esterilización líquida quedan por ser evaluadas.
La obtención de un dispositivo estéril y seguro requiere procesos de validación que se definen de acuerdo con los principios de gestión de la calidad y las instrucciones del fabricante del DMR y los fabricantes de esterilizadores.
IUSS to be replaced by steam sterilization
Go to IUSS sterilization →
1 of 16 Esterilizante líquidoTo be evaluated by WFHSS
Go to Liquid sterilization →
2 of 16 VaporSteam 134°C or 132°C preferred when allowed by RMD IFU
Go to Steam sterilization →
3 of 16 LTSFCycle according to RMD IFU
Go to Low temperature steam formaldehyde →
4 of 16 VH2O2Cycle according to RMD IFU
Go to Vaporized H2O2 →
5 of 16 EtOCycle according to RMD IFU
Go to Ethylene Oxide →
6 of 16 DMR limpio, seco y empaquetadoNon packaged for non terminal sterilization
Go to choice of sterilization process →
7 of 16 Dispositivo médico estérilNon packaged RMD for immediate use when non terminal sterilization
Packaged RMD for storage when terminal sterilization
Go to choice of sterilization process →
Terminal sterilization preferred to
non terminal
Go to choice of sterilization process →
9 of 16 Esterilización no terminalThe RMD is not protected by a packaging and must be immediately used after sterilization
Go to choice of sterilization process →
10 of 16 +Terminal sterilization preferred
Go to recommendation of WFHSS for sterilization →
11 of 16 +Steam sterilization at 132°C or 134°C preferred when allowed by RMD IFU
Go to recommendation of WFHSS for sterilization →
12 of 16 +Visual control and routine controls
Go to Sterilization and quality management →
13 of 16 +According to RMD IFU
Go to choice of sterilization process →
14 of 16 +Steam sterilization at 132°C or 134°C preferred when allowed by RMD IFU
Go to recommendation of WFHSS for sterilization →
15 of 16 +Visual control and routine controls
Go to Sterilization and quality management →
16 of 16- ISO 17665-1: Esterilización de productos sanitarios – Calor húmedo – Requisitos para el desarrollo, validación y control de rutina de un proceso de esterilización para dispositivos médicos – 2006
- ISO 17665-2: Esterilización de productos para el cuidado de la salud – Calor húmedo – Parte 2: Orientación sobre la aplicación de ISO 17665-1 – 2009
- ISO 17665-3: Esterilización de productos para el cuidado de la salud – Calor húmedo – Parte 3: Orientación sobre la designación de un dispositivo médico en una familia de productos y categoría de procesamiento para la esterilización por vapor – 2013
- EN 285: Esterilización – Esterilizadores de vapor – Esterilizadores grandes – 2016
- EN 13060: Esterilización – Esterilizadores de vapor – Esterilizadores de vapor pequeños – 2018
- ISO 20857: Esterilización de productos para el cuidado de la salud – Calor seco – Requisitos para el desarrollo, validación y control de rutina de un proceso de esterilización para dispositivos médicos – 2014
- ISO 11135: Esterilización de productos para el cuidado de la salud – Óxido de etileno – Requisitos para el desarrollo, validación y control de rutina de un proceso de esterilización para dispositivos médicos – 2014
- EN 1422: Esterilizadores para uso médico. Esterilizadores de óxido de etileno. Requisitos y métodos de prueba. 2014.
- ISO 25424: Esterilización de productos para el cuidado de la salud – Vapor y formaldehído a baja temperatura – Requisitos para el desarrollo, validación y control de rutina de un proceso de esterilización para dispositivos médicos – 2018
- ISO 14937: Esterilización de productos para el cuidado de la salud – Requisitos generales para la caracterización de un agente esterilizante y el desarrollo, validación y control de rutina de un proceso de esterilización para dispositivos médicos – 2009
- EN 14180: Esterilizadores de vapor y formaldehído a baja temperatura. Requisitos y pruebas
- ISO 22441: Esterilización de productos para el cuidado de la salud – Peróxido de hidrógeno vaporizado a baja temperatura – Requisitos para el desarrollo, validación y control de rutina de un proceso de esterilización para dispositivos médicos – (trabajo en progreso)
- EN 14180: Esterilizadores para uso médico.Esterilizadores de peróxido de hidrógeno a baja temperatura.Requisitos y pruebas (trabajo en curso).
- ISO 11140-1: Esterilización de productos sanitarios. Indicadores químicos. Parte 1: requisitos generales. 2014.
- ISO 11140-3: Esterilización de productos sanitarios. Indicadores químicos. Parte 3: Sistemas indicadores de clase 2 para su uso en la prueba de penetración de vapor tipo Bowie y Dick. 2007.
- ISO 11140-4 Esterilización de productos sanitarios – Indicadores químicos – Parte 4: Indicadores de clase 2 como alternativa a la prueba tipo Bowie y Dick para la detección de penetración de vapor – 2007
- ISO 11140-5 Esterilización de productos sanitarios – Indicadores químicos – Parte 5: Indicadores de clase 2 para pruebas de eliminación de aire tipo Bowie y Dick – 2007
- ISO 11140-6 Esterilización de productos sanitarios – Indicadores químicos – Parte 6: Indicadores de clase 2 y dispositivos de desafío de proceso para su uso en pruebas de rendimiento de esterilizadores de vapor (trabajo en curso)
- ISO 11138-1: Esterilización de productos sanitarios. Indicadores biológicos. Parte 1: Requisitos generales. 2017.
- ISO 11138-2: Esterilización de productos para el cuidado de la salud – Indicadores biológicos – Parte 2: Indicadores biológicos para procesos de esterilización por óxido de etileno – 2017
- ISO 11138-3: Esterilización de productos para el cuidado de la salud – Indicadores biológicos – Parte 3: Indicadores biológicos para procesos de esterilización por calor húmedo – 2006
- ISO 11138-4: Esterilización de productos para el cuidado de la salud – Indicadores biológicos – Parte 4: Indicadores biológicos para procesos de esterilización por calor seco – 2017
- ISO 11138-5: Esterilización de productos para el cuidado de la salud. Indicadores biológicos. Parte 5: Indicadores biológicos para procesos de esterilización con formaldehído y vapor a baja temperatura. 2017.
- ISO / AWI 11138-6: Esterilización de productos para el cuidado de la salud – Indicadores biológicos – Parte 6: Indicadores biológicos para procesos de esterilización por hidrógeno (trabajo en progreso)













