Стерилизация предназначена для очистки медицинских изделий многоразового использования от жизнеспособных микроорганизмов
Прионы не являются микроорганизмами и более устойчивы, чем обычные микроорганизмы.
Стерилизация RMD основана на 3 ключевых концепциях
Уровень достижения стерильности (SAL): Невозможно систематически контролировать полное отсутствие жизнеспособных микроорганизмов. Цель стерилизации состоит в том, чтобы ограничить вероятность выживания микроорганизмов до очень низкого уровня. Для RMD вероятность или Уровень достижения стерильности (SAL) выражается следующим образом: не более 1 жизнеспособного микроорганизма в количестве одного миллиона стерилизованных предметов (или 10-6 SAL).
Полное уничтожение: Количество, природа и местонахождение микроорганизмов, которые могут присутствовать на RMD после очистки, неизвестны. Процессы стерилизации RMD должны продемонстрировать свою способность инактивировать высококонцентрированный инокулят, содержащий более 1 миллиона тестируемых микроорганизмов. Тестируемые микроорганизмы отбираются за их высокую устойчивость к процессу стерилизации. Этот консервативный запас выше самого высокого уровня загрязнения в реальной жизни называется методом полного уничтожения.
Совместимость: RMD остается полностью функциональным и безопасным для использования после стерилизации. Совместимость проверяется производителем RMD, который определяет максимальное количество циклов стерилизации, которым может подвергаться RMD перед утилизацией или ремонтом.
В соответствии с международными стандартами предлагаются различные методы для демонстрации способности данного процесса стерилизации достигать SAL с использованием метода полного уничтожения. Одним из них является метод половины цикла полного уничтожения, описанный следующим образом:
Тесты проводятся с микроорганизмами, известными своей высокой устойчивостью к процессу стерилизации (обычно бактериальными спорами). Готовят 106 (6 log) инокулятов и помещают в стерилизационную камеру. Инокуляты подвергаются воздействию увеличивающегося времени (или увеличивающихся доз). Тесты повторяются, и результаты усредняются. кинетика инактивации характеризуется значением D, т.е. временем, необходимым для уменьшения микробной популяции на 90% или 1 логарифм. Если кинетика инактивации линейна, удвоение времени или дозы, убивающей 106 микроорганизмов, дает 10-6 SAL. Например, процесс со значением D, равным 2 минутам, деактивирует 6 log за 12 минут и достигает SAL за 24 минуты. После того как процесс охарактеризован, необходимо убедиться в том, что RMD можно эффективно стерилизовать. Инокулят 106 помещают в положение, определенное как наиболее трудное для стерилизации на RMD или внутри него. RMD упаковываются и вставляются в типичную сложную загрузку. В инструкциях по эксплуатации производителя RMD указано максимальное количество использований перед утилизацией или ремонтом.
Для рутинного контроля инокуляты могут быть помещены в устройства контроля процесса (PCD) | 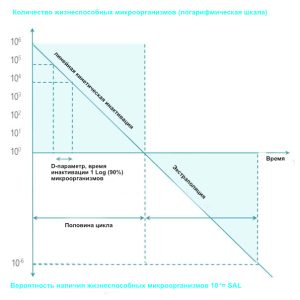 |
Процесс стерилизации, при котором RMD стерилизуется в упаковке, которая сохраняет его стерильность до использования, называется терминальной стерилизацией.
Терминальная стерилизация может быть произведена как при высокой, так и при низкой температуре.
Стерилизация паром является наиболее распространенным методом стерилизации. Это также называется стерилизацией влажным теплом или стерилизацией насыщенным паром),
Технология стерилизации характеризуется стерилизующим агентом, технологическими переменными и параметрами процесса. Например, в случае паровой стерилизации стерилизующим агентом является насыщенный пар. Переменными процесса являются давление, температура и время. 134°C - это пример параметра температурного процесса. При стерилизации сухим теплом RMD подвергаются воздействию сухого горячего воздуха. Низкотемпературная стерилизация (LTS) адаптирована к RMD, которые не выдерживают высоких температур. В настоящее время низкотемпературными стерилизующими агентами являются: Окись этилена (EtO), низкотемпературный пар с формальдегидом (LTSF), испаренная перекись водорода (VH2O2) и озон (O3). RMD подвергаются воздействию минимальной концентрации (куб.см) стерилизующего агента в условиях контролируемой температуры, влажности и/или давления в течение времени, необходимого для получения желаемого уровня достижения стерильности (SAL).
|
![]() Стерилизация радиацией (ионизирующим гамма–излучением, электронным пучком или рентгеновским излучением высокой энергии, или неионизирующим ультрафиолетовым излучением (УФ)) обычно не используется для обработки RMD в медицинских учреждениях и не будет обсуждаться в настоящих рекомендациях.
Стерилизация радиацией (ионизирующим гамма–излучением, электронным пучком или рентгеновским излучением высокой энергии, или неионизирующим ультрафиолетовым излучением (УФ)) обычно не используется для обработки RMD в медицинских учреждениях и не будет обсуждаться в настоящих рекомендациях.
Методы нетерминальной стерилизации соответствуют критериям SAL. Однако, в отличие от терминальной стерилизации, RMD не защищены упаковкой. Стерилизация паром немедленного использования (ранее называвшаяся мгновенной стерилизацией) является примером процесса нетерминальной стерилизации.
Все процессы стерилизации требуют соблюдения мер гигиены труда и техники безопасности.
- Высокое давление в камерах парового стерилизатора требует периодического контроля целостности камеры в соответствии с применимыми правилами или рекомендациями.
- Высокая температура пара и стерилизация сухим теплом подвергают операторов риску ожогов. RMD дают время остыть, а операторы надевают перчатки.
- Все низкотемпературные химикаты токсичны на различных уровнях (вот почему они эффективны в отношении микроорганизмов). Периодические проверки проверяют отсутствие утечек. Перед доступом к RMD остатки удаляются до уровней, определенных применимыми правилами охраны труда и техники безопасности.
На рынке предлагаются стерилизаторы различных размеров и конфигураций.
- Большие стерилизаторы используются в центральных стерилизационных установках. Часто используются системы с двойными дверями (сквозные).
- Настольные однодверные стерилизаторы используются в амбулаторных, стоматологических и сельских клиниках.
Выбор метода стерилизации производится в соответствии с принципами классификации Сполдинга и применимыми местными правилами или рекомендациями.
Общие предпочтения или тенденции можно резюмировать следующим образом :
- Терминальная стерилизация предпочтительнее нетерминальной стерилизации для RMD, поступающих в стерильные полости.
- Стерилизация паром рекомендуется для RMD, совместимых с влажностью и теплом. Наиболее эффективными являются паровые циклы при температуре 132 °C (270° F) или 134°C. Требуемое или рекомендуемое время выдержки варьируется от 3 минут до 18 минут в соответствии с применимыми правилами.
- Стерилизация сухим теплом запрещена во все большем числе стран из-за ее фиксирующих свойств и низких эксплуатационных характеристик по сравнению со стерилизацией паром.
- Для термочувствительных RMD выбор метода терминальной низкотемпературной стерилизации (LTS) соответствует требованиям IFU производителей RMD и может зависеть от региональных конвенций, руководств или нормативных актов. Испаренная перекись водорода (VH2O2) является наиболее широко распространенным методом LTS. Низкотемпературный паровой формальдегид (LTSF) не используется в странах с жестким регулированием прионов из-за его фиксирующих свойств. Использование EtO зависит от страны из-за фиксирующих свойств, длительного времени аэрации и ограничений по охране труда.
- Нетерминальный IUSS не используется в некоторых странах. В других случаях он остается переносимым, но, как правило, с рекомендациями использовать терминальную паровую стерилизацию.
- Приемлемость процессов нетерминальной стерилизации жидкими стерилянтами зависит от региона. В процессе стерилизации жидким стерилизатором RMD погружают в раствор с получением 10-6 SAL. Затем RMD промываются. RMD не защищены упаковкой. Следовательно, процесс стерилизации жидким стерилянтом не является терминальным.
Уровень гибкости остается за пользователем при выборе метода стерилизации, который зависит от местных правил или руководств. Например, в некоторых странах используется пар, за исключением случаев, когда это не разрешено инструкцией по эксплуатации производителя RMD. В других странах LTS используется или допускается для устройств, совместимых с паром, которые, как известно, портятся от многократного воздействия пара (например, оптика).
Соответствие процесса стерилизации международным стандартам может требоваться местными применимыми нормативными актами.
![]() специальные стандарты доступны для пара 1,2,3,4,5, для сухого тепла 6, для EtO7,8 и LTSF9,10. ISO 14937 используется для VH2O2 (в настоящее время разрабатываются специальные стандарты)12,13. Не существует непосредственно применимых международных стандартов для процессов жидкой стерилизации и IUSS.
специальные стандарты доступны для пара 1,2,3,4,5, для сухого тепла 6, для EtO7,8 и LTSF9,10. ISO 14937 используется для VH2O2 (в настоящее время разрабатываются специальные стандарты)12,13. Не существует непосредственно применимых международных стандартов для процессов жидкой стерилизации и IUSS.
- Кондиционирование подготавливает стерилизационную камеру и упакованный RMD к эффективной стерилизации. Например, температура в камере доводится до заданного уровня, и воздух, действующий как буфер между стерилизующим агентом и поверхностями RMD, удаляется вакуумом. Профили кондиционирования различаются (например, один вакуум или несколько вакуумных фаз). При некоторых технологиях стерилизации (например, EtO) фазе кондиционирования цикла стерилизации может предшествовать предварительная подготовка (например, для приведения RMD в заданный диапазон температуры и влажности).
- Воздействие стерилизующего агента в течение заданного времени и в контролируемых условиях приводит к получению SAL. Экспозиция включает время, необходимое для распределения стерилизующего агента в камере, через упаковку и на всех поверхностях RMD, включая полые геометрические формы.
- Удаление остатков стерилизации позволяет безопасно открывать дверцу камеры. Для десорбции токсичных химических веществ из абсорбирующего материала может потребоваться длительная фаза аэрации (например, в случае EtO). Какой бы ни была технология стерилизации, определены и строго применяются соответствующие меры по охране труда и технике безопасности. Отфильтрованный воздух подается в камеру для удаления конденсата (из пара) или для удаления токсичных остатков с камеры и поверхностей загрузки. Удалению остатков может способствовать давление, изменение температуры или другие средства. При высокотемпературной стерилизации RMD дают остыть. При необходимости аэрация во время или после цикла позволяет десорбировать токсичные остатки из загрузки.
Письменные стандартные операционные процедуры (СОП) описывают операции и средства контроля, которые необходимо выполнять до, во время и после цикла стерилизации. Для недавно приобретенного RMD определяется новый СОП, если существующий не может быть использован.
- Систематически проверяется срок годности расходных материалов (стерилизующего средства и других). Продукт, срок годности которого истек, выбрасывается в соответствии с инструкцией производителя и местными правилами.
- Состав загрузки предопределен.
- Каждый предмет имеет химический индикатор (CI). Международный стандарт ISO 11140-114 классифицирует химические индикаторы на 6 типов (без иерархической значимости), как указано в таблице 1. Большинство местных руководств требуют CI типа 1. Некоторые руководящие принципы предполагают дополнительные показатели типа 3, 4, 5 или 6. Таблица 1.
Таблица 1 . Классификация химических индикаторов
|
- Использование биологических индикаторов (BI) зависит от правил или руководств страны и технологии стерилизации. BI соответствуют международным стандартам19,20,21,22,23,24
- Биологические индикаторы обычно представляют собой автономные бактериологические индикаторы (SCBI).
| B SCBI биологический индикатор и среда, необходимые для инкубации и выделения тестируемых микроорганизмов, заключены в стерильную барьерную систему. После воздействия среда асептически приводится в контакт с BI. Ответ, предоставленный SCBI, - это двоичный рост без роста. Время считывания колеблется от 48 часов до нескольких часов и даже меньше с новым поколением BI. Быстрое считывание позволяет обнаруживать ферменты, которые надежно имитируют поведение тестируемых микроорганизмов. SCBI часто включает в себя функцию устройства, вызывающую сложные процессы. Устройство для контроля процесса определяется международным стандартом ISO 11139 (2018) как “изделие, обеспечивающее определенную устойчивость к процессу очистки, дезинфекции или стерилизации и используемое для оценки эффективности процесса”. В случае SCBI извилистый путь затрудняет проникновение стерилизующего агента в капсулу, содержащую BI. Чтобы задача PCD была значимой, ее необходимо сравнить с медицинскими устройствами многоразового использования, предназначенными для стерилизации. BI находятся в сложном положении в загрузке. |
- Расположение загрузки обеспечивает равномерное распределение стерилизующего средства. Загрузка осуществляется с учетом соображений охраны труда и техники безопасности
- Рутинные проверки (при необходимости) выполняются с периодичностью, рекомендованной международным стандартом или определенной местными правилами
- Циклы адаптируются к нагрузке. Управление циклом автоматизировано, но персонал должен присутствовать и обучен реагировать на сигналы тревоги и опасные ситуации. Международные стандарты требуют средств для обнаружения отклонений в системе управления и независимой записи данных цикла.
| Производитель стерилизатора должен предоставить средства, позволяющие избежать программного или аппаратного сбоя системы управления, который остается необнаруженным, и чтобы недействительный цикл выглядел действительным. На практике независимые датчики дважды проверяют, находятся ли технологические переменные в пределах заданных допусков. Например, в случае стерилизации паром датчик температуры, который регулирует температуру процесса, удваивается независимым датчиком температуры. Независимая сенсорная технология не обязательно должна быть одинаковой, если отклонение функции управления надежно обнаружено. Инструкции по эксплуатации производителя предоставляет инструкции пользователю в случае обнаружения отклонений. Независимые данные должны быть записаны для прослеживаемости. |
- Контроль после цикла точно описан, результаты записаны, а отклонения зафиксированы и представлены в отчете, как определено в СОП. Каждый элемент находится под визуальным контролем. Если это не сделано перед стерилизацией, для прослеживаемости применяется маркировка. Параметры цикла контролируются. Контролируются изменения цвета химических индикаторов типа 1. Другие CI (если используются) контролируются, а BI (см. ниже) отправляются на инкубацию
- Функции открывания двери и разгрузки защищены. Воздействие токсичных остатков и ожоги предотвращаются путем соблюдения соответствующих мер по охране труда и технике безопасности.
- Описаны и распределены обязанности по выпуску загрузки. Резервные копии организованы таким образом, чтобы обеспечить непрерывность процесса.
Выпуск загрузки (т.е. официальное разрешение на распространение RDM для хранения и использования) выполняется аккредитованным лицом. Лицо, ответственное за выпуск загрузки, в идеале отличается от лица, ответственного за контроль загрузки. Минимальными требованиями для выпуска загрузки являются:
В соответствии со стандартной операционной процедурой (СОП) может потребоваться дополнительный химический индикатор (отличный от типа 1). Химические индикаторы (СI), помещенные в упаковку, контролируются в месте использования персоналом операционной. Результаты не являются обязательным условием для выпуска загрузки. Однако в случае положительного химического индикатора проводится анализ рисков, чтобы определить, должны ли некоторые или все товары быть обработаны или отозваны. Когда используются BI, они инкубируются и анализируются в соответствии с инструкцией производителя биологических индикаторов. СОП медицинских учреждений определяют меры в случае положительного BI. Анализ риска определяет, является ли это ложноположительным результатом (что, как известно, случается) или истинным признаком проблемы. В зависимости от документированного результата анализа рисков, решение может быть следующим: выпуск загрузки (поскольку другой контроль дал уверенность в том, что цикл соответствует), частичный выпуск или повторная обработка всей загрузки. Требования к выпуску загрузки варьируются в зависимости от страны и технологий стерилизации.
|
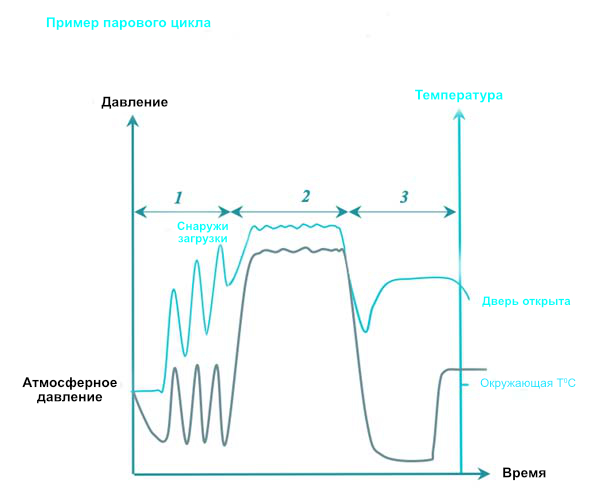
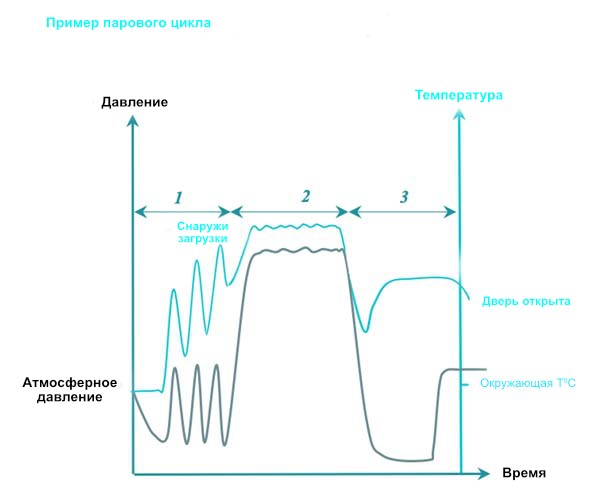
При паровой стерилизации горячий насыщенный пар покрывает все поверхности RMD в течение определенного времени, установленного в соответствии с рекомендациями. Насыщенный означает, что пар поддерживается в устойчивом состоянии между жидкой и паровой фазами с очень низким процентным содержанием жидкой фазы. В таблице значений приведены условия давления и температуры для насыщения паром.
3 фазы циклов паровой стерилизации следующие:
- Кондиционирование: Последовательный вакуум и впрыск пара удаляют воздух из камеры и загружают и заменяют его насыщенным паром. Температура загрузки постепенно повышается.
- Экспозиция: Впрыск насыщенного пара завершен, и ему дается время для диффузии через нагрузку. Все поверхности RMD должны подвергаться воздействию насыщенного пара. Температура и время воздействия определяются местными правилами или руководящими указаниями. Обычно используются температуры 134°C или 132°C (270°F), в зависимости от региона. Время выдержки варьируется от 3 до 18 минут (из-за регулирования прионов). На протяжении фазы воздействия конденсация и понижение температуры компенсируются нагнетанием насыщенного давления до конца периода плато. Если указано в инструкции производителя RMD, температура понижается до 121 ° C или 125 ° C со временем воздействия 15 минут или более.
- Удаление: Конденсат удаляется с помощью вакуума и нагрева. Откройте дверцу, чтобы дать загрузке остыть, чтобы оператор мог безопасно обращаться с загрузкой.
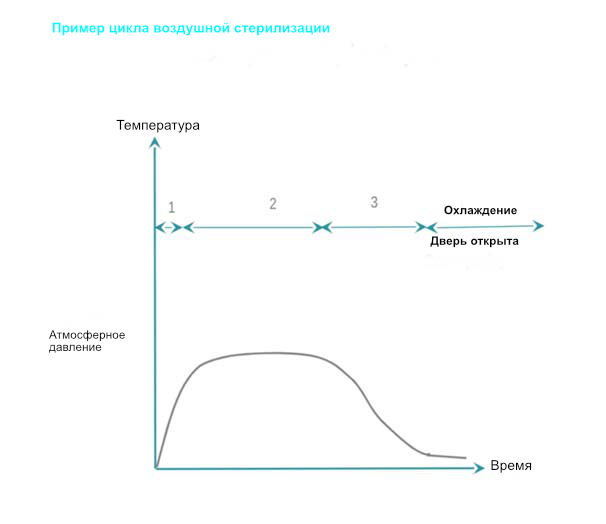
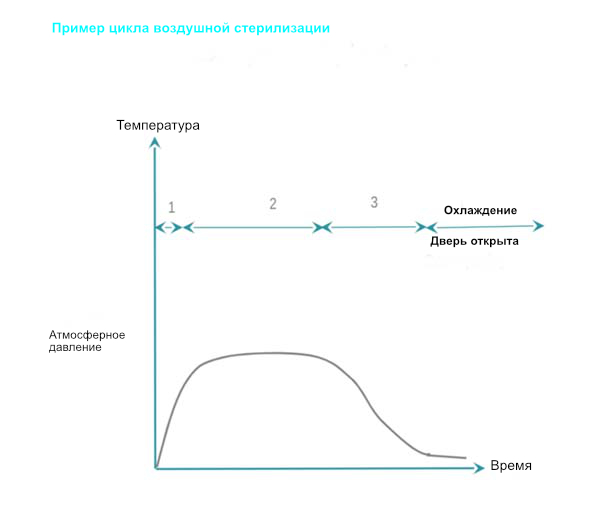
Сухое тепло обеспечивает стерилизацию с помощью кондукции. Тепло поглощается RMD и перемещается внутри RMD слой за слоем. Чтобы RMD был полностью стерилизован, он должен достичь требуемой температуры. По сравнению со стерилизацией паром, температура сухого нагрева T ° C и время, необходимое для достижения эффективности, выше и дольше, показатели проникновения плохие, а время остывания больше. Стерилизация сухим теплом запрещена во все большем числе стран из-за его фиксирующих свойств. Как провести сухую воздушную стерилизацию:
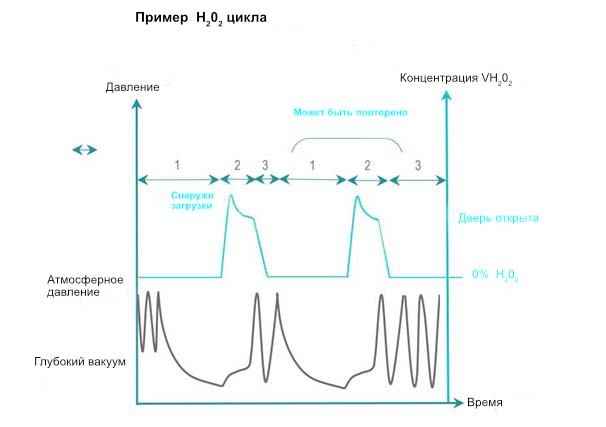
Стерилизация испаренной перекисью водорода приводит поверхности RMD в контакт с испаренной H2O2 (Н2О2) в определенной концентрации и в течение времени процесса, необходимого для SAL. VH2O2 получается путем испарения жидкого раствора стерилянта (обычно концентрация выше 50%). Некоторые циклы увеличивают концентрацию VH2O2 перед распределением в камере.
- Кондиционирование: Воздух отводится с помощью однократного или многократного вакуумирования, которое также может способствовать, наряду с другими методами, удалению остаточных следов влажности. Загрузка подается в пределах заданного температурного диапазона.
- Экспозиция: Испаренный Н2О2 впрыскивается и диффундирует в камере, через загрузку и упаковку, образуя сложную геометрию. Н2О2 разлагается при взаимодействии или поглощении материалом. Доза Н2О2 подается в камеру и гарантирует, что все поверхности подвергаются воздействию времени и условий концентрации, необходимых для SAL. Концентрация Н2О2 контролируется прямо или косвенно с помощью давления.
- Удаление: Остатки воды и Н2О2, оставшиеся или адсорбированные загрузкой, удаляются вакуумом или дополнительными средствам
Схемы кондиционирования, экспозиции и удаления могут повторяться один или несколько раз. Кондиционирование фаз повторения может быть упрощено по сравнению с первоначальным кондиционированием. Обычно общее количество повторных фаз (включая первую) четное. Цикл заканчивается окончательным удалением, обычно усиленным по сравнению с предыдущими удалениями.
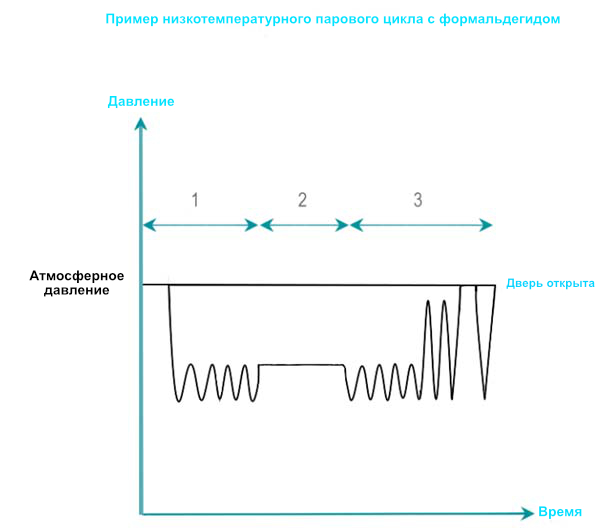
Формальдегид (HCHO) — бесцветный газ, хорошо растворимый в воде. Формальдегид получают путем испарения раствора при различных концентрациях формальдегида (ниже 35%). Способность формальдегида к инактивации значительно повышается при наличии влажности.
- Кондиционирование: Начальный вакуум удаляет воздух из камеры и загрузки. С помощью импульсов давления остаточный воздух постепенно заменяется паром и формальдегидом с помощью импульсов давления.
- Время выдержки: В течение времени воздействия температура, концентрация стерилизующего средства, давление и влажность поддерживаются в заданных пределах. LTSF по себе работает при температуре 80, 65, 60, 55 или 50°C (176, 149, 140, 131 или 122° F) при относительной влажности от 75 до 100 %.
- Удаление: Смесь формальдегида и пара удаляется из загрузки повторными вакуумными и паровыми пульсациями с последующим глубоким вакуумом. Аэрация позволяет десорбировать формальдегид из RMD до уровней, которые не будут вредными для операторов и пациентов. Остатки жидкого формальдегида разбавляются до уровня, разрешенного местными правилами обращения с отходами.
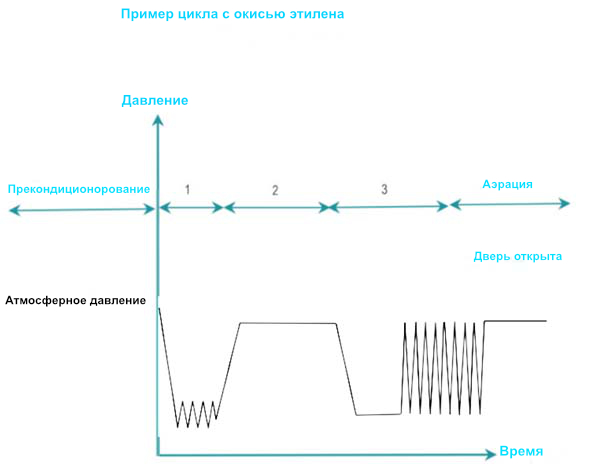
ЭО — бесцветный ядовитый газ, который поражает клеточные белки и нуклеиновые кислоты микроорганизмов. Технологические температуры ЭО варьируются от 25 до 55°C. Более низкая температура приводит к менее эффективному процессу и более длительному времени выдержки. ЭО канцерогенен для человека и легко воспламеняется. Требуются особые условия в помещении, оборудование для обеспечения безопасности и отдельные системы вентиляции.
- Кондиционирование: Остаточный воздух удаляется вакуумными импульсами и постепенно заменяется ЭО, смешанным с паром. Температура и влажность зарузки регулируются до заранее заданных уровней. Предварительная подготовка может потребоваться для приведения больших загрузок в заданный диапазон влажности и температуры.
- Экспозиция: Целевая концентрация ЭО, влажность и температура стабилизируются до окончания заданного времени экспозиции.
- Удаление: Остатки ЭО удаляются вакуумными импульсами. Во время фазы аэрации ЭО дается время на десорбцию из загрузки. Аэрация может быть продолжена вне камеры при строго контролируемых условиях охраны труда и техники безопасности. Общее время аэрации варьируется от 12 до 48 часов
Паровая стерилизация немедленного использования (IUSS) — это вариант паровой стерилизации, предназначенный для экстренной нетерминальной стерилизации в месте использования. RMD не упакованы. Передача пользователю осуществляется немедленно и с осторожностью в контролируемой среде. По сравнению со стерилизацией паром, RMD не упаковываются, сушка и охлаждение обычно сокращаются, чтобы ограничить время цикла. Таким образом, RMD, следовательно, может оставаться влажным по завершении цикла, тем самым увеличивая риск загрязнения окружающей среды.
3 фазы IUSS заключаются в следующем :
- Кондиционирование: Вакуумирование и впрыск пара удаляют воздух из камеры и загрузки и заменяют его насыщенным паром. Температура нагрузки постепенно повышается.
- Выдержка: Впрыск насыщенного пара завершен, и ему дается время для распространения по всей загрузке.
- Удаление: Конденсат удаляется с помощью вакуума и нагрева. После открытия дверцы загрузке дают остыть для безопасного обращения оператора.
![]() Международных стандартов для IUSS не существует.
Международных стандартов для IUSS не существует.
![]() Местные правила или руководящие принципы могут требовать или рекомендовать, чтобы стерилизация проводилась в централизованном стерилизационном отделении, тем самым запрещая стерилизацию в месте использования. Операционные, как правило, не оборудованы и не организованы для такой последовательной очистки и сушки RMD, как централизованное отделение стерилизации.
Местные правила или руководящие принципы могут требовать или рекомендовать, чтобы стерилизация проводилась в централизованном стерилизационном отделении, тем самым запрещая стерилизацию в месте использования. Операционные, как правило, не оборудованы и не организованы для такой последовательной очистки и сушки RMD, как централизованное отделение стерилизации.
Воздействие на все поверхности RMD жидкого стерилянта в течение контролируемого времени, температуры и концентрации приводит к получению целевого SAL. Ополаскивание должно сохранить SAL.
Наиболее распространенным стерилянтом является надуксусная кислота. Очистка обычно отделяется от нанесения стерилизующего средства.
- Кондиционирование: Кондиционирование может не потребоваться. Очистка может быть включена в цикл или выполняться отдельно.
- Экспозиция: Все поверхности RMD подвергаются воздействию стерилянта при заданной температуре и условиях и в течение заданного времени.
- Удаление: Остатки стерилизующего средства удаляются путем промывки. Промывка сохраняет SAL. Если в цикл включена сушка, то при сушке сохраняется SAL.
Письменные стандартные рабочие процедуры (СОП) по очистке и дезинфекции подготовлены в соответствии с принципами менеджмента качества.
Пользователь контролирует или выполняет и контролирует валидацию процесса:
- Установка стерилизатора соответствует рекомендациям производителя
- Имеются сертификаты инструкции по эксплуатации, испытаний и калибровки
- Стандартные операционные процедуры (СОП) обновлены. Для недавно приобретенного RMD определяется новый СОП, если существующий не может быть использован.
- Налажен регулярный контроль
- Приняты меры по охране труда и технике безопасности
- Обучение (включая обучение по охране труда и технике безопасности) проводится в актуальном состоянии, и имеются сертификаты об обучении.
- Планы технического обслуживания имеются для всего стерилизационного оборудования
- Прослеживаемость работает

Основные рекомендации WFHSS по очистке и дезинфекции
- Терминальная стерилизация, соответствующая международным стандартам, предпочтительнее нетерминальной стерилизации.
Для терминальных методов стерилизации предпочтительной температурой стерилизации является пар при температуре 134 ° C или 132 ° C, и она может использоваться, если указано в инструкции по эксплуатации производителя RMD. Время воздействия варьируется в зависимости от правил или руководств страны.
Стерилизацию сухим теплом следует заменить паровой.
Для RMD, которые не совместимы с паром при температуре 132 °C или 134 °C, в инструкции производителя RMD указаны методы стерилизации либо паром при температуре от 121 °C до 125 °C, либо низкотемпературной стерилизацией, а также используемые циклы. Выбор низкотемпературных методов стерилизации осуществляется в соответствии с нормативными, руководящими принципами, практическими соображениями или соображениями охраны труда и техники безопасности.
Требования к жидкостной стерилизации еще предстоит оценить.
- Для получения стерильного и безопасного изделия требуется валидация процесса, которая определяется в соответствии с принципами менеджмента качества и инструкциями по эксплуатации производителей RMD и стерилизаторов.
IUSS to be replaced by steam sterilization
Go to IUSS sterilization →
1 of 16 Liquid sterilant Жидкий стерилянтTo be evaluated by WFHSS
Go to Liquid sterilization →
2 of 16 Steam ПарSteam 134°C or 132°C preferred when allowed by RMD IFU
Go to Steam sterilization →
3 of 16 LTSF Низкотемпературный пар с формальдегидомCycle according to RMD IFU
Go to Low temperature steam formaldehyde →
4 of 16 VH2O2 Испарённая перикись водородаCycle according to RMD IFU
Go to Vaporized H2O2 →
5 of 16 EtO ЭтиленоксидCycle according to RMD IFU
Go to Ethylene Oxide →
6 of 16 Чистое, сухое упакованное медицинское изделие многократного применения (RMD)Non packaged for non terminal sterilization
Go to choice of sterilization process →
7 of 16 Sterile Medical Device Стерильное медицинское изделиеNon packaged RMD for immediate use when non terminal sterilization
Packaged RMD for storage when terminal sterilization
Go to choice of sterilization process →
Terminal sterilization preferred to
non terminal
Go to choice of sterilization process →
9 of 16 Нетерминальная стерилизацияThe RMD is not protected by a packaging and must be immediately used after sterilization
Go to choice of sterilization process →
10 of 16 +Terminal sterilization preferred
Go to recommendation of WFHSS for sterilization →
11 of 16 +Steam sterilization at 132°C or 134°C preferred when allowed by RMD IFU
Go to recommendation of WFHSS for sterilization →
12 of 16 +Visual control and routine controls
Go to Sterilization and quality management →
13 of 16 +According to RMD IFU
Go to choice of sterilization process →
14 of 16 +Steam sterilization at 132°C or 134°C preferred when allowed by RMD IFU
Go to recommendation of WFHSS for sterilization →
15 of 16 +Visual control and routine controls
Go to Sterilization and quality management →
16 of 16- ISO 17665-1: Стерилизация изделий медицинского назначения – Влажное тепло – Требования к разработке, валидации и обычному контролю процесса стерилизации медицинских изделий – 2006
- ISO 17665-2: Стерилизация медицинских изделий – Влажное тепло – Часть 2: Руководство по применению ISO 17665-1 – 2009
- ISO 17665-3: Стерилизация изделий медицинского назначения – Влажное тепло – Часть 3: Руководство по отнесению медицинского изделия к семейству продуктов и категории обработки для паровой стерилизации – 2013
- EN 285: Стерилизация – Паровые стерилизаторы – Большие стерилизаторы – 2016
- EN 13060: Стерилизация – Паровые стерилизаторы – Небольшие паровые стерилизаторы – 2018
- ISO 20857: Стерилизация изделий медицинского назначения – Сухое нагревание – Требования к разработке, валидации и регулярному контролю процесса стерилизации медицинских изделий — 2014
- ISO 11135: Стерилизация изделий медицинского назначения – Окись этилена – Требования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий – 2014
- EN 1422: Стерилизаторы для медицинских целей – Стерилизаторы на основе окиси этилена – требования и методы испытаний – 2014
- ISO 25424: Стерилизация изделий медицинского назначения – Низкотемпературный пар и формальдегид – Требования к разработке, валидации и регулярному контролю процесса стерилизации медицинских изделий – 2018
- ISO 14937: Стерилизация изделий медицинского назначения – Общие требования к характеристике стерилизующего средства и разработке, валидации и регулярному контролю процесса стерилизации медицинских изделий – 2009
- EN 14180: Низкотемпературные паровые и формальдегидные стерилизаторы. Требования и тестирование
- ISO 22441: Стерилизация изделий медицинского назначения – Низкотемпературная испаренная перекись водорода – Требования к разработке, валидации и обычному контролю процесса стерилизации медицинских изделий – (работа продолжается)
- EN 14180: Стерилизаторы для медицинских целей – Низкотемпературные стерилизаторы с перекисью водорода – требования и испытания (работа продолжается)
- ISO 11140-1: Стерилизация медицинских изделий – Химические показатели – Часть 1: общие требования — 2014
- ISO 11140-3: Стерилизация медицинских изделий – Химические индикаторы – Часть 3: Индикаторные системы класса 2 для использования в испытании на проникновение пара типа Боуи и Дика – 2007
- ISO 11140-4 Стерилизация медицинских изделий – Химические индикаторы – Часть 4: Индикаторы класса 2 в качестве альтернативы тесту типа Боуи и Дика для определения проникновения пара – 2007
- ISO 11140-5 Стерилизация медицинских изделий – Химические индикаторы – Часть 5: Индикаторы класса 2 для испытаний на удаление воздуха типа Боуи и Дика – 2007
- ISO 11140-6 Стерилизация медицинских изделий – Химические индикаторы – Часть 6: Индикаторы класса 2 и устройства для контроля процесса для использования при тестировании производительности паровых стерилизаторов (работа продолжается)
- ISO 11138-1: Стерилизация медицинских изделий – Биологические показатели – Часть 1: Общие требования — 2017
- ISO 11138-2: Стерилизация изделий медицинского назначения – Биологические индикаторы – Часть 2: Биологические индикаторы для процессов стерилизации оксидом этилена – 2017
- ISO 11138-3: Стерилизация медицинских изделий – Биологические индикаторы – Часть 3: Биологические индикаторы для процессов стерилизации влажным теплом – 2006
- ISO 11138-4: Стерилизация медицинских изделий – Биологические индикаторы – Часть 4: Биологические индикаторы для процессов стерилизации сухим теплом – 2017
- ISO 11138-5: Стерилизация изделий медицинского назначения – Биологические индикаторы – Часть 5: Биологические индикаторы для процессов низкотемпературной стерилизации паром и формальдегидом – 2017
- ISO/AWI 11138-6: Стерилизация медицинских изделий – Биологические индикаторы – Часть 6: Биологические индикаторы для процессов стерилизации водородом (работа продолжается)
Copyright 2021 Ⓒ WFHSS / Development by Benedetto.S













